Projekt-Zusammenfassung
Ziel dieses Europäischen Forschungsverbunds ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix sowie der dazugehörige Aufbau und Logistik einer Biobank von speziell charakterisierten und mit einer neuen Methode kryokonservierten Stammzelllinien.
Wussten Sie schon?
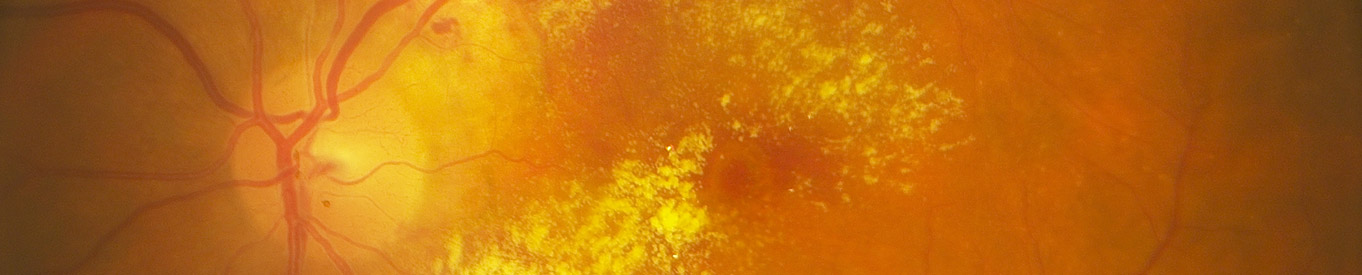
Optische Reize werden von der Netzhaut aufgenommen und durch den Nervus Optikus zu den primären und sekundären optischen Zentren des Zentralnervensystems weitergeleitet. Die Netzhaut reicht vom Sehnervenkopf bis zur Ora serrata. Nur an diesen beiden Stellen ist sie fest mit der Unterlage verbunden. Bei der mikroskopischen Untersuchung erkennt man in der sensorischen Netzhaut acht Schichten sowie das Pigmentepithel und die Bruchsche Membran. Die Macula lutea (gelber Fleck) ist ein speziell differenziertes kreisförmiges Netzhautareal. Es reicht temporal von der Papille im horizontalen Meridian bis ca. 5,5 mm nach temporal. Eine Besonderheit stellt auch die Vaskularisation der zentralen Retina dar. Eine doppelte Gefäßversorgung sichert den außerordentlich lebhaften retinalen Stoffwechsel. Sowohl der retinale als auch der chorioidale Kreislauf können Ursprung pathologischer Prozesse sein. Die Avaskularitat der Foveola wird augenscheinlich kompensiert durch Reichtum von Ziliararterien, die in die Aderhaut hinter der Makula eintreten. Das retinale Pigmentepithel zeichnet sich durch eine eindrucksvolle Reaktionsfähigkeit aus. Sie reicht von der permanenten Phagozytose der nachwachsenden Rezeptorspitzen bis zur fibrösen "Pseudometaplasie".
 Klinischer Hintergrund
Klinischer Hintergrund
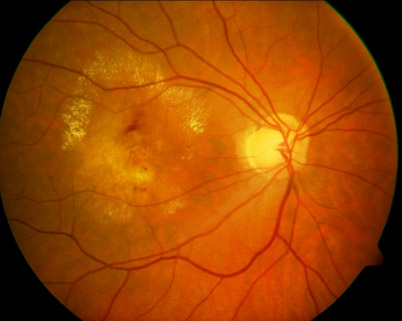
Ein funktionierendes Retinales Pigmentepithel (RPE) ist Grundvoraussetzung zur Erhaltung der äußeren neuralen Retina und Choriokapillaris. Pathophysiologische, aber auch altersbedingte Veränderungen des RPE können vielerlei Konsequenzen für umliegende Strukturen nach sich ziehen, beispielsweise für die Bruch’sche Membran (BM), die Choriokapillaris, die Photorezeptoren oder die extrazelluläre Matrix. Diese tragen infolge zur Pathogenese multipler Visusbeeinträchtigungen bei, u.a. auch zur Altersbedingten Makuladegeneration (AMD). Sie ist die häufigste Erblindungsursache in den Industriestaaten. Ca. 8,7 % der Weltbevölkerung leiden daran. Die zurzeit verfügbaren Medikamente können AMD nur verlangsamen, nicht heilen. Eine lebenslange Therapie mit hohen Kosten und großem Aufwand ist für die Patienten nötig.
Warum sind bestehende Standardtherapien nicht ausreichend?
Die einzige Therapie, die bisher nachweislich eine AMD dauerhaft heilen kann, ist die subretinale Membranextraktion mit autologem Ersatz der retinalen Pigmentepithelzell- (RPE) Schicht. Die bisherigen Methoden (Makulatranslokation, RPE-Bruch-Aderhautpatch) zeigen jedoch eine unvertretbar hohe Komplikationsrate und haben sich deshalb nicht durchgesetzt.
Deutlich weniger Invasivität verspricht die Technik der subretinalen RPE-Transplantation. Versuche haben gezeigt, dass eine subretinale Transplantation von retinalen Pigmentepithelzellen (RPE-Zellen) die Funktionen der Retina deutlich verbessert. Erste Langzeitstudien an AMD-Patienten, bei denen autologe RPE-Zellen aus peripheren Arealen isoliert, ex-vivo aufkonzentriert und wieder subretinal unter die Makula injiziert wurden, zeigen ebenfalls die Unbedenklichkeit und eine Verbesserung des Visus. Allerdings ist dieser Ansatz limitiert durch:
- Geringe Polarität der sedimentierten Zellen
- Keine Ausbildung eines konfluenten Zellrasens
- Eine autologe Transplantation in AMD-Patienten behält die genetische Disposition für AMD bei. In der Praxis zeigen Patienten mit Aderhautpatch eine erneute Ausbildung areolärer Atrophie-Areale.
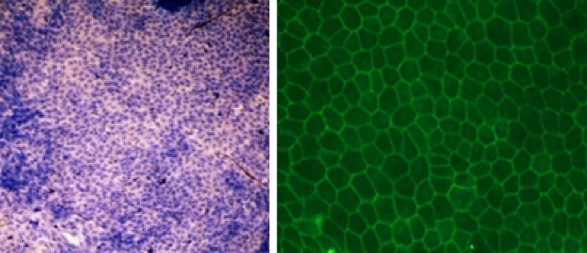
Konfluent kultivierte Stammzellen zur Behandlung der Makuladegeneration
Zielsetzung
Ziel dieses Projektes ist die Etablierung einer neuen Methode zur Transplantation konfluenter induzierter pluripotenter Stammzellen (iPS) auf einer Trägermatrix. Dazu werden iPS-Zelllinien zunächst charakterisiert und zur Konfluenz gebracht. Anschließend werden sie zu RPE-Zellen redifferenziert und auf einer Trägermatrix bis zur Konfluenz kultiviert. Der charakterisierte iPS-RPE-Patch wird unter die Netzhaut transplantiert. Ziel des Europäischen Forschungsverbunds ist die Etablierung von speziell charakterisierten Zelllinien und mit einer neuen Methodik kryokonservierten Stammzelllinien in einer Kryobank. Der Versand eines individualisierten iPS-RPE-Patches an die transplantierende Klinik erfolgt in einer lückenlosen Kühlkette, so dass das Transplantat direkt vor der Operation aufgetaut und sich nativ ohne Funktionsverlust transplantieren lässt. Dazu wird eine neue endoskopische Operationstechnik zur minimal-invasiven Transplantation dieser iPS-RPE-Patches entwickelt.
Wie ist der Projektstand?
Das Vorhaben gewinnt durch die Expertise von international anerkannten Kooperationspartnern an Bedeutsamkeit und befindet sich aktuell im Verfahren um ein positives BMBF-Votum.
Das Projektteam
PD Dr. Dr. med. Boris Stanzel (Arbeitsgruppenleiter)
Dr. med. Annekatrin Rickmann
Dr. rer. nat. Silke Wahl
Prof. Dr. med. Peter Szurman